จีพลัสมีองค์ประกอบที่สำคัญคือสาร ไคโตโอลิโกเมอร์และโมโนเมอร์ (Chitooligomers and Monomers – COAMs) ซึ่งโดยทั่วไปไคโตซานโอลิโกเมอร์ หรือ ไคโตโอลิโกเมอร์ หมายถึงไคโตซานที่ผ่านกระบวนการย่อยสลาย (Degradation) มีระดับการเกิดพอลิเมอร์ (Degree of Polymerization-DP) น้อยกว่า 20 (เช่น DP6 = เฮกซาเมอร์-Hexamer, DP1 = โมโนเมอร์-Monomer) และมีน้ำหนักโมเลกุล (Molecular Weight-MW) เฉลี่ยน้อยกว่า 3.9 kDa (โดยทั่วไปคือ 0.2-3.0 kDa) นอกจากนี้ยังมีความสามารถในการละลายได้มากขึ้น และมีคุณสมบัติที่โดดเด่น ได้แก่ ความสามารถในการย่อยสลายทางชีวภาพ (Biodegradable) ความเข้ากันได้ทางชีวภาพ (Biocompatible) ความสามารถในการดูดซับ (Adsorptive capacities) และไม่เป็นพิษ (Non-toxic) เช่นเดียวกับ ไคตินและไคโตซาน (Liang, S. et al., 2018 : Schmitz, C. et al., 2019)
1. การตรวจวัดน้ำหนักและขนาดโมเลกุล (Molecular weight and particle size examination)
1.1 การทดสอบหาค่าน้ำหนักโมเลกุล (Molecular weight test)
โดยใช้ Gel Permeation Chromatography (GPC) และ Viscometry ของไคโตซานที่ผ่านย่อยสายโมเลกุลด้วยวิธี อัลตร้าโซนิค เป็นระยะเวลา 0 ถึง 10 นาที รายละเอียดดังแสดงในตารางที่ 1
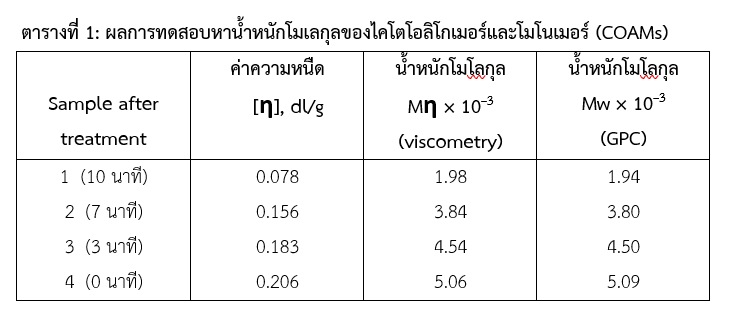
ผลการทดลองพบว่าการใช้อัลตร้าโซนิค ทำให้น้ำหนักโมเลกุลที่วัดจากค่าความหนืดและวัดด้วยเทคนิค GPC มีค่าลดลงอย่างมีนัยสำคัญ (p<0.01) การทดสอบสารไคโตโอลิโกเมอร์ในจีพลัสนี้พบว่ามีน้ำหนักโมเลกุล 1.94-1.98 kDa ซึ่งโดยทั่วไปน้ำหนักโมเลกุลของไคโตโอลิโกเมอร์และโมโนเมอร์จะมีค่าน้อยกว่า 3.9 kDa (Liang, S. et al., 2018) จึงยืนยันได้ว่าองค์ประกอบในจีพลัสคือ สารไคโตโอลิโกเมอร์และโมโนเมอร์
1.2 วัดขนาดโมเลกุล (Particle size measurement)
ทำการวัดขนาดโมเลกุลโดยศูนย์ตรวจวิเคราะห์ NCTC (NSTDA Characterization and Testing Service Center) ของ สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) โดยใช้เครื่อง Nano Particle Analyzer, Horiba Model: SZ-100V2 ได้ขนาดโมเลกุลดังแสดงในตารางที่ 2
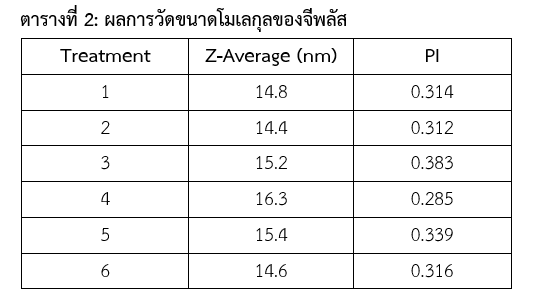
จากผลการทดสอบพบว่าโมเลกุลของจีพลัส มีขนาดโมเลกุล 15.12+0.69 นาโนเมตร ซึ่งมีขนาดเล็กมากกว่าปากใบพืชที่มีขนาด 19.1-71.5 ไมครอน (Jordan, G.J. et al., 2015) ยืนยันได้ว่าสามารถใช้จีพลัสในการฉีดพ่นทางใบได้ และพืชสามารถดูดซึมโมเลกุลของจีพลัสเข้าทางปากใบ และนำไปใช้ได้ทันที
2. การทดสอบการยับยั้งเชื้อรา (Antifungal test)
ทดสอบการยับยั้งเชื้อราของสาร COAMs ในจีพลัส โดย ผศ.ดร. ขวัญจรัส เชิงปัญญา มหาวิทยาลัยแม่โจ้ วิทยาเขตแพร่ ด้วยการทดสอบการยับยั้งการเติบโตของไมซีเลียมเชื้อรา (mycelial growth inhibition) ของเชื้อ Colletotrichum gloeosporioides ซึ่งเป็นเชื้อราก่อโรคแอนแทรคโนส (Anthracnose) โดยเทียบประสิทธิภาพในการยับยั้งไมซีเลียมของสาร COAMs ในจีพลัส ที่ผลิตจากกระบวนการต่างๆ คือ enzymatic method (COAMs) และ cold plasma method ที่ใช้ก๊าซ Argon (COAMs-Ar) และ Helium (COAMs-He) กับกลุ่มควบคุม (ไม่ได้ใช้สารใดๆ) และยาเคมีกำจัดเชื้อราคาร์เบนดาซิม (carbendazim) พบว่าสาร COAMs สามารถยับยั้งการเจริญของไมซีเลียมได้ดีกว่ากลุ่มควบคุมอย่างมีนัยสำคัญ และเทียบเท่ากับยาเคมีคาร์เบนดาซิม ผลของ relative inhibition ของ COAMs 96.62+5.19%, COAMs-Ar 99.66+3.42%, COAMs-He 100% และคาร์เบนดาซิม 95.52+2.52% ดังแสดงในรูปที่ 1
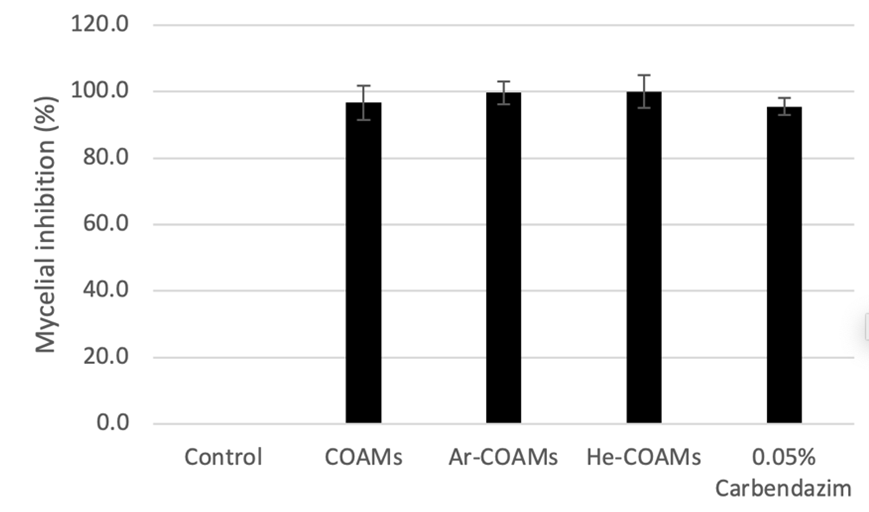
COAMs, Ar-COAMs, He-COAMs และ Carbendazim
นอกจากนี้เมื่อทดสอบกับเชื้อ Fusarium pseudensiforme พบว่าสาร COAMs ในจีพลัส สามารถยับยั้งเชื้อรานี้ได้ โดยมีค่า relative inhibition คือ 99.77+0.51% ซึ่งยับยั้งได้ดีกว่าในกลุ่มยาเคมีคาร์เบนดาซิม
จากผลการทดสอบการกำจัดเชื้อรานี้ สามารถสรุปได้ว่า สาร COAMs ที่เป็นองค์ประกอบในผลิตภัณฑ์จีพลัสนั้น สามารถยับยั้งหรือกำจัดเชื้อราได้ดีมีประสิทธิภาพที่ดีกว่าสารคาร์เบนดาซิม
3. การใช้ผลิตภัณฑ์ในพื้นที่การเพาะปลูก (Field test)
ทำการลงพื้นที่และทดสอบผลิตภัณฑ์ในพื้นที่การเพาะปลูก โดย ดร.ภาคภูมิ วัชรขจร หลักสูตรปริญญาเอก การบริหารจัดการเกษตรอินทรีย์ วิทยาลัยนานาชาติ มหาวิทยาลัยแม่โจ้
3.1 การกำจัดโรคจากเชื้อราในทุเรียน
ทำการวิจัยและทดสอบผลิตภัณฑ์จีพลัส โดยใช้ร่วมกับผลิตภัณฑ์กรีนพลัสซี่งเป็นจุลินทรีย์กำจัดเชื้อราในดินและปรับปรุงสภาพดิน เทียบกับการใช้ยาเคมีเมธาแลกซิล ในการกำจัดโรครากเน่าโคนเน่าในพื้นที่สวนทุเรียนภาคตะวันออก จังหวัดจันทบุรีและ ตราด รวม 12 สวน เนื้อที่ประมาณ 1,200 ไร่
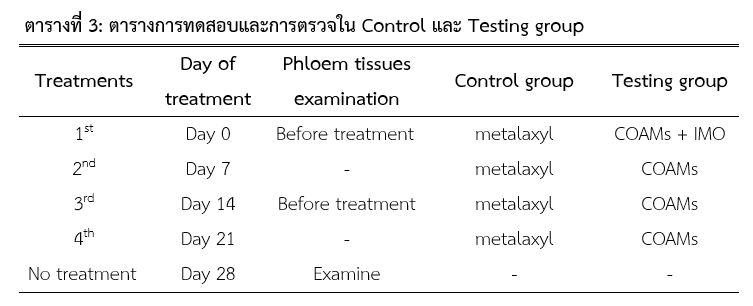
การทดสอบนี้ได้แบ่งทุเรียนเป็น 2 กลุ่ม กลุ่มละ 10 ต้น กลุ่มแรก (Control group) ใช้เมทาแลกซิลพ่น และทาที่ต้นเหมือนที่ชาวสวนเคยปฏิบัติกันอยู่ ในกลุ่มที่สอง (Testing group) ใช้กรีนพลัสผสมน้ำแล้วพ่นลงดินในวันแรก และใช้จีพลัสฉีดพ่นที่ต้นและใบทุกๆ 7 วัน จำนวน 4 ครั้ง (ตารางที่ 3)
การวิเคราะห์ความแตกต่างของข้อมูล โดยใช้ค่าสถิติ t-Test: Two-Sample Assuming Unequal Variances ที่ระดับความเชื่อมั่น 99% คำนวณโดยโปรแกรม Microsoft Excel
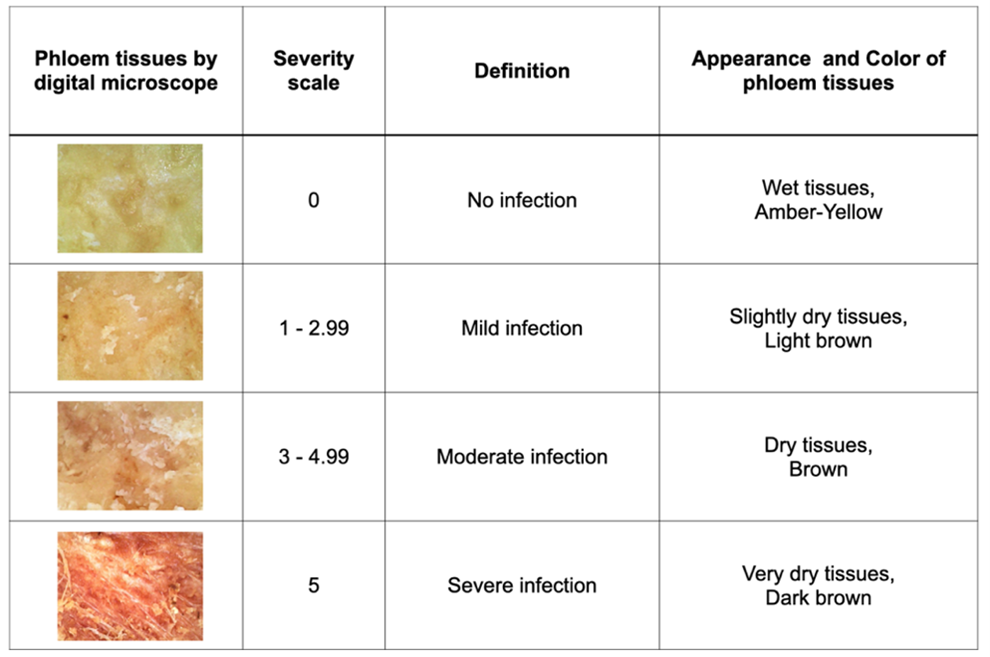
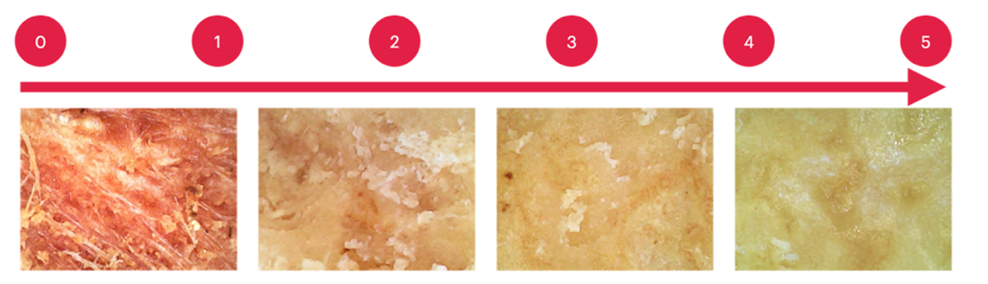
ประเมินระดับความรุนแรงของโรค (Severity scales) โดยพิจารณาจากเนื้อเยื่อที่ตรวจด้วยกล้องจุลทรรศน์ดิจิทัล ใช้วิธีการตรวจดังแสดงในรูปที่ 2 และใช้ข้อกำหนดเพื่อพิจารณาระดับความรุนแรงของโรค ดังแสดงในรูปที่ 3

(1) ใช้มีดคม (2) กะเทาะเปลือกของลำต้นทุเรียน (3) ใช้กล้องจุลทรรศน์ดิจิทัลส่องตรวจดูเนื้อเยื่อท่อน้ำเลี้ยง
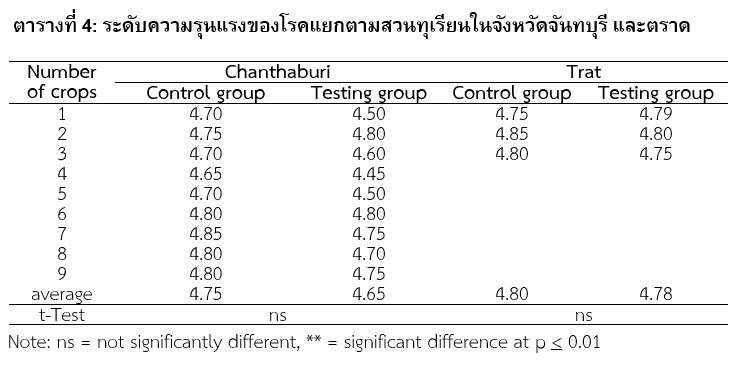
จากการประเมินความรุนแรงในสวนทุเรียนที่ใช้ในการวิจัยนี้ ดังแสดงในตารางที่ 4 พบว่าในทุกสวนที่ใช้ในการวิจัยครั้งนี้มีระดับความรุนแรงไม่แตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p>0.01)
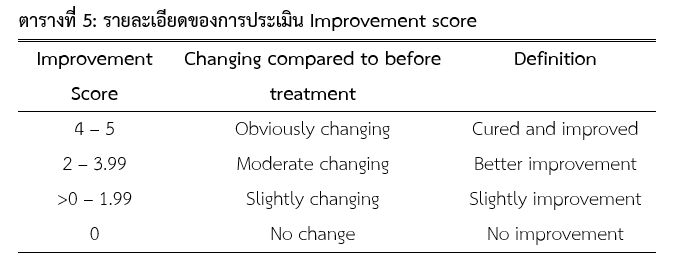
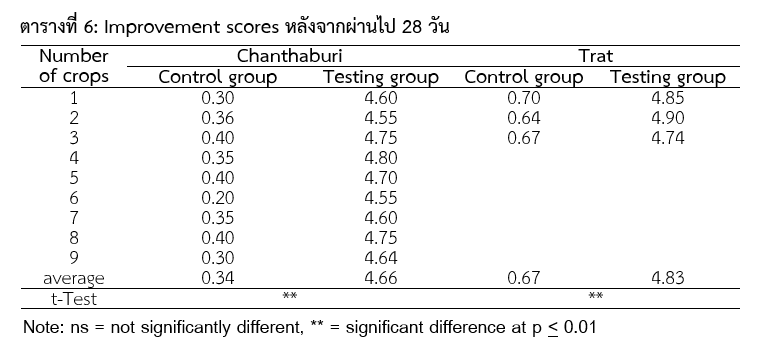
หลังจากการทดสอบ 14 และ 28 วัน ประเมินผลการหายจากโรคโดยใช้ Improvement score (ใช้บอกถึงอาการของทุเรียนดีขึ้น โดย 0 คือไม่เปลี่ยนแปลง ถึง 5 คือมีการเปลี่ยนแปลงอย่างชัดเจน) พิจารณาจากลักษณะเนื้อเยื่อของทุเรียนดังแสดงในรูปที่ 4 และให้คะแนนโดยพิจารณาจากข้อมูลในตารางที่ 5
จากผล Improvement scores ในตารางที่ 6 พบว่า ใน Control group มีผลเฉลี่ยของ Improvement scores เท่ากับ 0.34 และ 0.67 ในสวนทุเรียนที่จังหวัดจันทบุรี และตราด ตามลำดับ และ ใน Testing group มีผลเฉลี่ยของ Improvement scores เท่ากับ 4.66 และ 4.83 ในสวนทุเรียนที่จังหวัดจันทบุรี และตราด ตามลำดับ เมื่อเปรียบเทียบค่าเฉลี่ยระหว่างสองกลุ่ม พบว่าในกลุ่ม Testing group มี Improvement score ดีกว่า Control group อย่างมีนัยสำคัญทางสถิติ
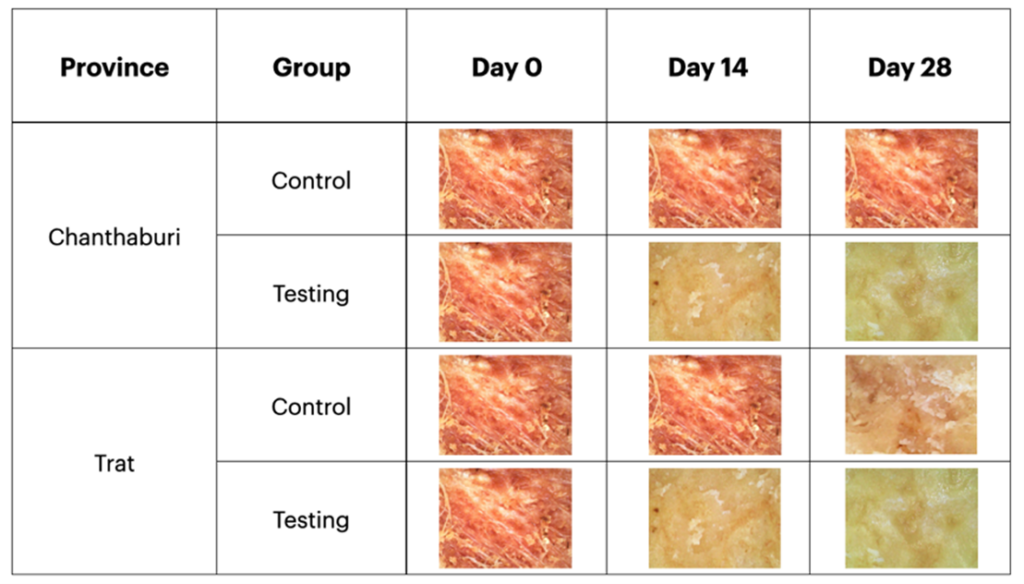
พิจารณาจากเนื้อเยื่อทุเรียนที่ดูผ่านกล้องจุลทรรศน์ดิจิทัล ในวันที่ 14 และ 28 ดังแสดงในรูปที่ 5 พบว่าเนื้อเยื่อใน Control group ที่ใช้เมทาแลกซิลนั้นไม่ค่อยมีการเปลี่ยนแปลง คือมีลักษณะแห้ง เนื้อเยื่อเป็นสีแดง แสดงถึงยังคงมีการติดเชื้อ ส่วนใน Testing group ที่ใช้จีพลัสและกรีนพลัสนั้นมีการเจริญของเนื้อเยื่อใหม่ มีลักษณะชุ่มน้ำ เนื้อเยื่อสีเหลืองหรือขาว ซึ่งแสดงว่าหายจากการติดเชื้อรา (รูปที่ 5)
นอกจากนี้เมื่อกะเทาะเปลือกของต้นทุเรียนออกแล้ว พบว่าหลังจากการใช้จีพลัสและกรีนพลัส 14 วันลักษณะภายนอกของเนื้อเยื่อทุเรียน เห็นสีเหลืองหรือขาว แสดงถึงต้นทุเรียนหายจากโรครากเน่าโคนเน่า มีการสร้างเนื้อเยื่อขึ้นมาใหม่ เห็นการเปลี่ยนแปลงที่ชัดเจนเมื่อเทียบกับก่อนการใช้ผลิตภัณฑ์ ดังแสดงในรูปที่ 6

(A) ก่อนการใช้ และ (B) หลังการใช้ จีพลัสและกรีนพลัส 14 วัน
สรุปผลและวิจารณ์
จีพลัสมีองค์ประกอบที่สำคัญคือ สารไคโตโอลิโกเมอร์และโมโนเมอร์ (COAMs) โดยมีน้ำหนักโมเลกุลเฉลี่ยน้อยกว่า 3.9 kDa มีคุณสมบัติที่โดดเด่น ได้แก่ ความสามารถในการย่อยสลายทางชีวภาพ (Biodegradable) ความเข้ากันได้ทางชีวภาพ (Biocompatible) ความสามารถในการดูดซับ (Adsorptive capacities) และไม่เป็นพิษ (Non-toxic) เช่นเดียวกับ ไคตินและไคโตซาน (Liang, S. et al., 2018 : Schmitz, C. et al., 2019)
สารในจีพลัสมีขนาดโมเลกุล 15.12+0.69 นาโนเมตร ซึ่งมีขนาดเล็กมากกว่าปากใบพืชที่มีขนาด 19.1-71.5 ไมครอน (Jordan, G.J. et al., 2015) ยืนยันได้ว่าสามารถใช้จีพลัสในการฉีดพ่นทางใบได้ และพืชสามารถดูดซึมโมเลกุลของจีพลัสเข้าทางปากใบ และนำไปใช้ได้ทันที
สาร COAMs ที่เป็นองค์ประกอบในจีพลัสนั้นมีฤทธิ์ในการยับยั้งเชื้อ Colletotrichum gloeosporioides และ Fusarium pseudensiforme โดยคาดว่ากลไกการยับยั้งเชื้อรานั้นเนื่องจากประจุบวกของสาร COAMs ทำปฏิกิริยากับประจุลบบนผนังเซลล์เชื้อโรค และโมเลกุลขนาดเล็กของ COAMs สามารถผ่านผนังเซลล์เชื้อโรคเข้าไปยับยั้งการเจริญเติบโตได้อีกด้วย ทำให้สามารถยับยั้งและกำจัดเชื้อโรคได้ จึงสรุปได้ว่าสาร COAMs มีฤทธิ์ในการยับยั้งหรือกำจัดเชื้อราสาเหตุโรคพืชได้
ผลการวิจัยและทดสอบในการรักษาโรครากเน่าโคนเน่าที่เกิดจากเชื้อรากลุ่มไฟทอปธอร่า และฟิวซาเรียมนี้ สามารถสรุปได้ว่าการใช้จีพลัสร่วมกับกรีนพลัส มีประสิทธิภาพในการรักษาโรครากเน่าโคนเน่าได้ดีกว่าการใช้ยาเคมีเมธาแลกซิลอย่างมีนัยสำคัญทางสถิติ ในสภาวะปัจจุบันที่มีการดื้อยาต่อเมทาแลกซิลนั้น จีพลัสและกรีนพลัสจึงเป็นทางเลือกที่ดีในการรักษาโรครากเน่าโคนเน่าในทุเรียน และเนื่องจากกรีนพลัสและจีพลัสผลิตจากสารธรรมชาติ ทำให้มีความปลอดภัยต่อคน สัตว์ และสิ่งแวดล้อมอีกด้วย
เอกสารอ้างอิง
- Hadwiger, L.A. 2017. Chitosan molecular-forms with potential in agriculture and medicine. J Drug Des Res, 4(2), 1036, 1-4.
- Ing, L.Y., Zin, N.M., Sarwar, A., Katas, H. 2012. Antifungal activity of chitosan nanoparticles and correlation with their physical properties. Int J Biomater., 632698. doi: 10.1155/2012/632698
- Jordan, G.J., Carpenter, R.J., Koutoulis, A., Price, A. & Brodribb, T.J. 2015. Environmental adaptation in stomatal size independent of the effects of genome size. New Phytologist, 205, 608–617. doi: 10.1111/nph.13076
- Ke, C.-L., Deng, F.-S., Chuang, C.-Y. & Lin, C.-H. 2021. Antimicrobial actions and applications of chitosan. Polymers, 13, 904. Available https://doi.org/10.3390/polym13060904
- Liang, S., Sun, Y. & Dai, X. 2018. A review of the preparation, analysis and biological functions of chitooligosaccharide. International Journal of Molecular Sciences, 19(2197), 1-19.
- Schmitz, C., González Auza, L., Koberidze, D., Rasche, S., Fischer, R. & Bortesi L. 2019. Conversion of chitin to defined chitosan oligomers: current status and future prospects. Marine Drugs, 17(8):452. Available https://doi.org/10.3390/md17080452












